Opioides, analgesia y control del dolor
¿Qué es el dolor?
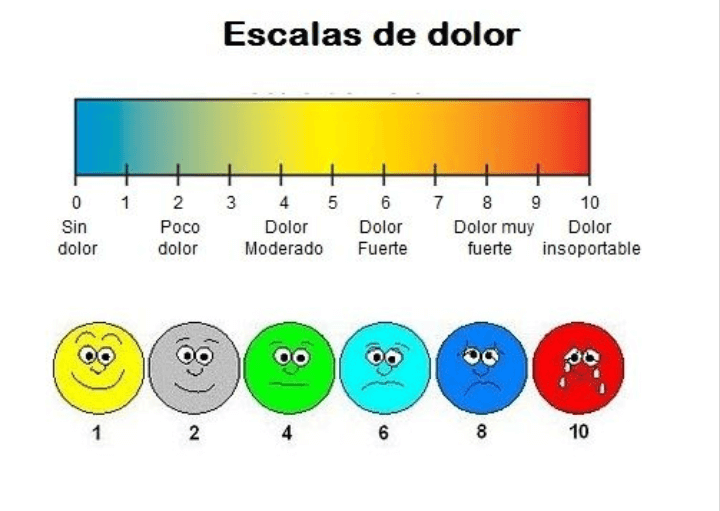
Es un componente de prácticamente todas las patologías clínicas, y el manejo de este es un imperativo clínico primario. Es una percepción sensorial localizada y subjetiva que puede ser más o menos intensa, molesta o desagradable. Este se clasifica de acuerdo a su duración e intensidad:
Opioides
El término opioide se refiere a compuestos estructuralmente relacionados con los productos que se encuentran en el opio, palabra derivada de opos que es la palabra griega para “jugo”; los opioides naturales se derivan de la resina de la adormidera, Papaver somniferum.
Péptidos opioides endógenos
Una molécula biológica que se encuentra dentro del cerebro, que actúa a través de un receptor opioide, es un opioide endógeno. Los precursores peptídicos opioides son una familia proteica definida por la prohormona de la que se derivan. Se han identificado varias familias distintas de péptidos opioides endógenos: principalmente encefalinas, endorfinas y dinorfinas.
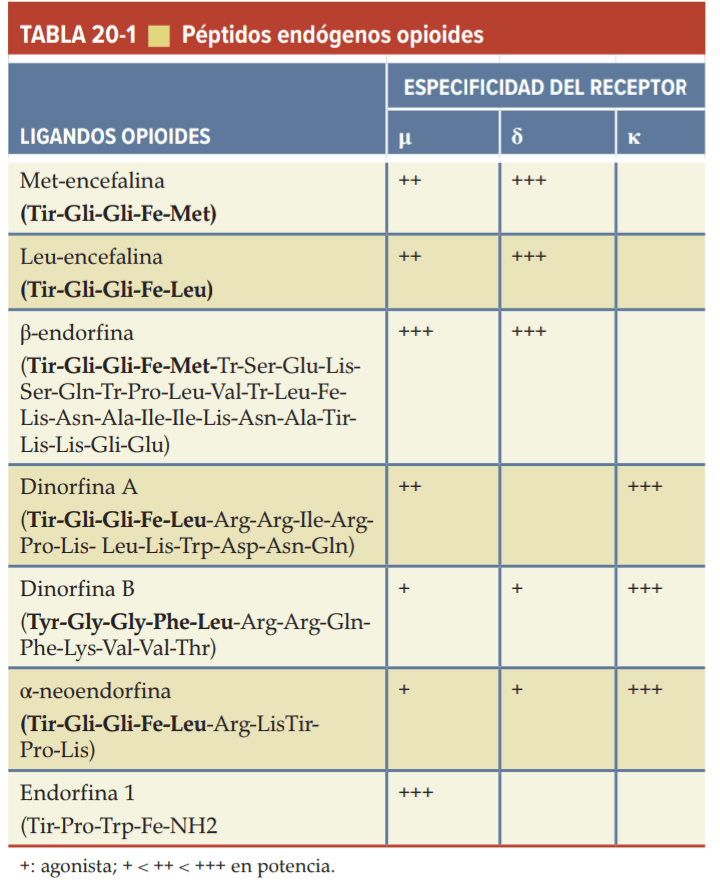
Proopiomelacortina
El principal péptido opioide derivado de POMC es el potente agonista opioide β-endorfina. La secuencia de POMC también se procesa en una variedad de péptidos no opioides, que incluyen ACTH, α-MSH y β-LPH.
Proencefalina
La prohormona contiene múltiples copias de met-encefalina, así como una única copia de leu-encefalina. Los péptidos de proencefalina están presentes en áreas del CNS que se cree que están relacionadas con el procesamiento de la información del dolor (por ejemplo, asta dorsal de la médula espinal, el núcleo espinal del trigémino y el PAG); a la modulación del comportamiento afectivo (por ejemplo, amígdala, hipocampo, locus ceruleus y la corteza cerebral frontal).
Prodinorfina
La prodinorfina contiene tres péptidos de diferentes longitudes que comienzan con la secuencia leu-encefalina: dinorfina A, rimorfina (dinorfina B) y neoendorfina.
Endomorfinas
Los péptidos de endomorfinas pertenecen a una nueva familia de péptidos que incluyen endomorfina 1 y endomorfina 2.
Receptores de opioides
Efectos de ipioides de uso clínico
Los opioides, en dependencia de las especificidades de sus receptores, producen una variedad de efectos consistentes con los roles desempeñados por los sistemas orgánicos con los cuales se asocian los receptores. Aunque el uso clínico primario de los opioides está dado por sus propiedades analgésicas, ellos producen una serie de otros efectos. Esto no es sorprendente si se tiene en cuenta la amplia distribución de los receptores opioides en el cerebro, la médula espinal y la periferia. Dentro del sistema nervioso, estos efectos van desde la analgesia hasta los efectos sobre la motivación y el afecto de orden superior (euforia), la excitación y una serie de procesos autónomos, hormonales y motores. En la periferia, los opioides pueden influir en una variedad de sistemas visceromotores, incluidos los relacionados con la motilidad GI y el tono del músculo liso.
Analgesia
Los fármacos similares a la morfina producen analgesia, somnolencia y euforia (cambios en el estado de ánimo y el entorpecimiento mental). Cuando se administran dosis terapéuticas de morfina a pacientes con dolor, éstos informan que el dolor es menos intenso o que desaparece por completo. Además del alivio de la angustia, algunos pacientes pueden experimentar euforia.
Cualquier análisis significativo sobre la acción de los agentes analgésicos debe incluir la apreciación de que todo dolor no es el mismo, y que una serie de variables contribuyen al informe del dolor por parte del paciente y, por tanto, al efecto del analgésico. Heurísticamente, es posible pensar que el dolor consiste en varios conjuntos distintos de eventos:
- Nicicepción
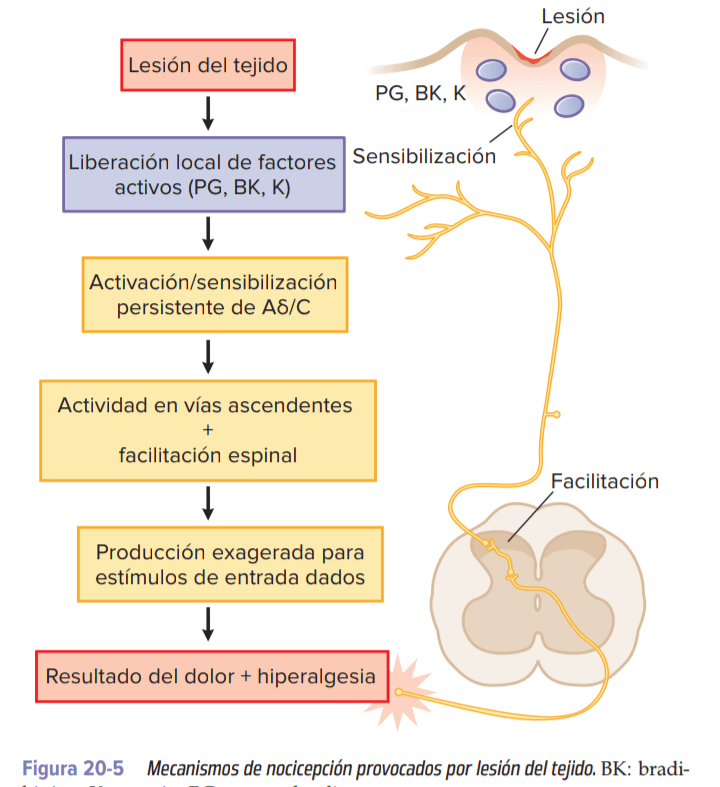
- Lesión tisular
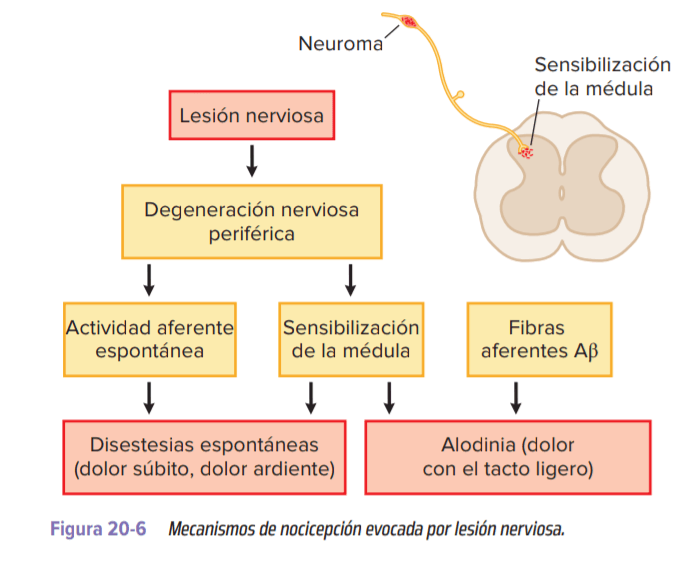
- Lesión nerviosa
Dimensiones sensoriales contra afectivas
La información generada por un estímulo periférico de alta intensidad inicia la actividad en las vías que activan los sistemas de orden superior que reflejan la magnitud aversiva del estímulo.
Mecanismos de la analgesia inducida por opioides
Las acciones analgésicas de los opioides después de administración sistémica representan acciones en el cerebro, la médula espinal y, en algunos casos, la periferia.
Acciones supraespinales.
Las microinyecciones de morfina en varias regiones cerebrales altamente circunscritas producirán una analgesia potente que es reversible con naloxona, un antagonista de MOR. El mejor caracterizado de estos sitios es la región PAG mesencefálica. Existen varios mecanismos por los cuales los opioides con acción limitada a PAG pueden actuar para alterar la transmisión nociceptiva.
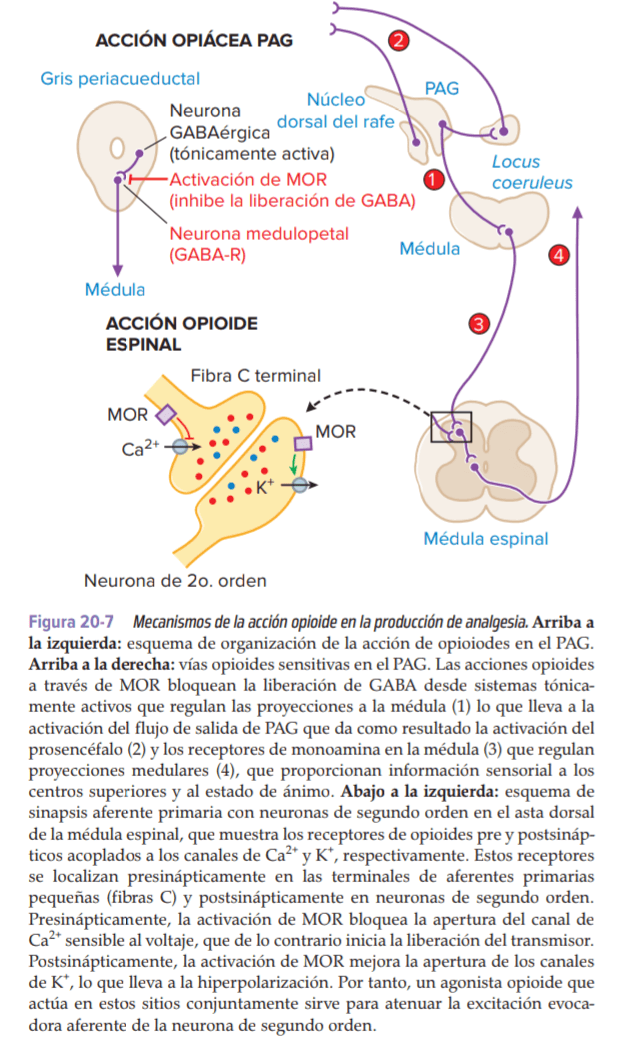
Acción de los opioides en la médula espinal.
La acción local de los opioides en la médula espinal presionará selectivamente la descarga de las neuronas del cuerno dorsal espinal evocadas por fibras nerviosas aferentes pequeñas (alto umbral) pero no grandes (bajo umbral).
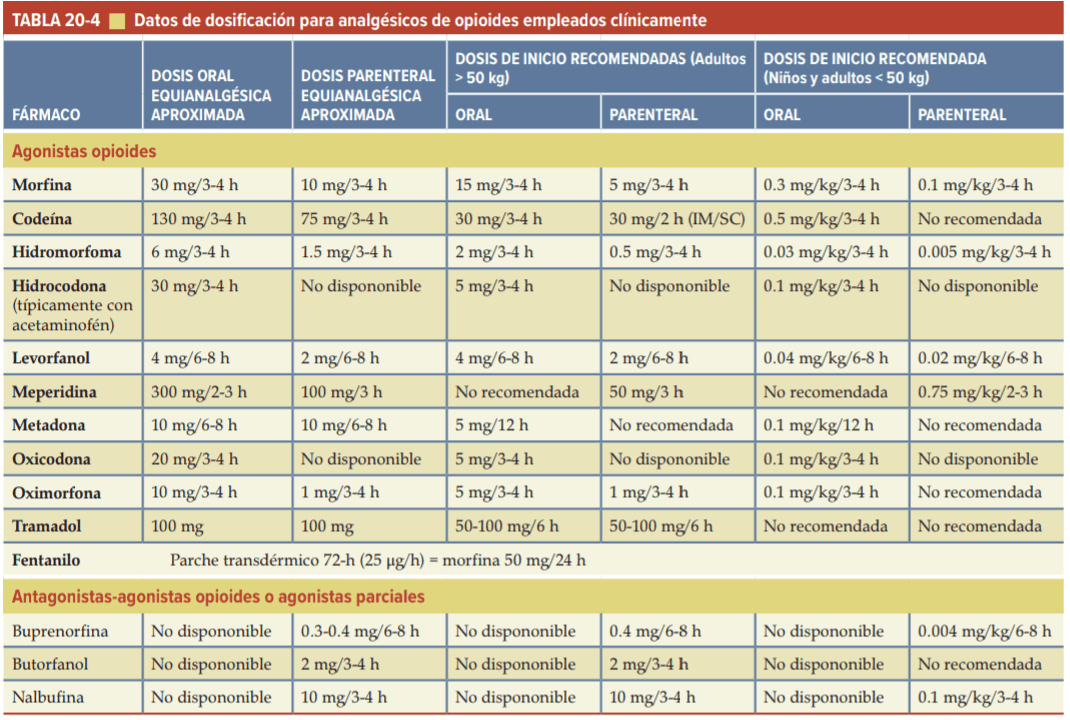
Medicamentos opioides empleados clínicamente
La mayoría de los agonistas opioides de uso clínico son relativamente selectivos para los MOR. Producen analgesia, afectan el estado de ánimo y el comportamiento gratificante, y alteran las funciones respiratoria, cardiovascular, gastrointestinal y neuroendocrina. Los agonistas KOR, con algunas excepciones (p. ej., butorfanol), no suelen emplearse para el tratamiento a largo plazo porque pueden producir efectos disfóricos y psicotomiméticos. Los agonistas DOR, aunque son analgésicamente activos, no han encontrado utilidad clínica, y los agonistas NOR carecen de efectos analgésicos. Los opioides que son relativamente selectivos para los receptores a dosis más bajas pueden interactuar con tipos de receptores adicionales cuando se administran en dosis altas, especialmente a medida que se aumentan las dosis para superar la tolerancia.
Antagonistas opioides
Una variedad de agentes se unen competitivamente a uno o más de los receptores opioides, muestran poca o ninguna actividad intrínseca y antagonizan de forma sólida los efectos de los agonistas de receptores. Cambios relativamente menores en la estructura de un opioide pueden convertir un fármaco que es principalmente un agonista en uno con acciones antagónicas en uno o más tipos de receptores opioides.
Propiedades farmacológicas
Los antagonistas opioides tienen una utilidad terapéutica obvia en el tratamiento de la sobredosis de opioides. En circunstancias normales, estos antagonistas producen pocos efectos en ausencia de un agonista exógeno. Sin embargo, bajo ciertas condiciones (p. ej., choque), cuando se activan los sistemas opioides endógenos, la administración de un antagonista opioide solo puede tener efectos positivos sobre los cambios hemodinámicos.
Usos terapéuticos
- Tratamiento de sobredosis de opioides
- Tratamiento del estreñimiento
- Tratamiento de síndromes de abuso
Consideraciones terapéuticas en el control del dolor
Dado su profundo impacto en la fisiología y calidad de vida del paciente, el tratamiento del dolor debe ser un elemento importante en cualquier intervención terapéutica. La incapacidad para manejar adecuadamente el dolor puede tener importantes consecuencias negativas en la función fisiológica, como la hiperreactividad autonómica (aumento de la presión arterial, frecuencia cardiaca, supresión de la motilidad gastrointestinal, secreciones reducidas); y movilidad reducida, lo que lleva a un desacondicionamiento, desgaste muscular, endurecimiento de las articulaciones y descalcificación; y puede contribuir a cambios perjudiciales en el estado psicológico (depresión, síndromes de impotencia, ansiedad).
Variables que modifican el uso terapéutico de opioides
Variabilidad del paciente
Existe una considerable variabilidad individual en la respuesta a los opioides. Por tanto, una dosis intramuscular estándar de 10 mg de sulfato de morfina aliviará el dolor intenso de forma adecuada en dos de tres pacientes, pero no será suficiente en uno de tres pacientes. De manera similar, la concentración analgésica efectiva mínima para los opioides, como morfina, meperidina (petidina), alfentanilo y sufentanilo, varía entre los pacientes en factores de 5-10. Los ajustes deben hacerse en función de la respuesta clínica.

Dolor
Intensidad del dolor
El aumento de la intensidad del dolor puede requerir dosis ajustadas para producir una analgesia aceptable con efectos secundarios tolerables.
Tipo de estado del dolor
Los sistemas subyacentes a un estado de dolor pueden clasificarse en términos generales como mediados por eventos secundarios a lesiones e inflamación y por lesión del sistema nervioso o de los sistemas sensoriales aferentes. Las condiciones neuropáticas pueden tratarse con menos eficacia con opioides que el dolor secundario a lesión e inflamación de tejido. Dichos estados de dolor se manejan de manera más eficiente me-diante la combinación de modalidades de terapéuticas.
Agudeza y cronicidad del dolor
En estados de dolor crónico, el curso diario del dolor puede fluctuar, por ejemplo, ser más intenso en las horas de la mañana o al despertar. Los estados artríticos muestran picos asociados con una condición de dolor exacerbada.
Tolerancia a los opioides
La exposición crónica a un agonista opioide generalmente conduce a una reducción en la eficacia de otros agonistas opioides. El grado de tolerancia puede ser notable.
Vías de administración
Normalmente se eligen las vías menos invasivas, como la administración oral, bucal o transdérmica, para facilitar el cumplimiento por parte del paciente. Las vías intravenosas son más útiles en el manejo del dolor prehospitalario y posoperatorio y durante la atención al final de la vida.
Usos terapéuticos no analgésicos de los opioides
Disnea
La morfina se usa para aliviar la disnea de la insuficiencia ventricular izquierda aguda y el edema pulmonar; la respuesta del paciente a la morfina intravenosa puede ser dramática. El mecanismo que subyace a este alivio pronunciado no está claro. Puede implicar una alteración de la reacción del paciente a la función respiratoria deteriorada y una reducción indirecta del trabajo del corazón debido a la reducción del miedo y la aprensión.
También se usa como adyuvantes anestésicos.
Nuevos tratamientos no opioides para el dolor
Múltiples toxinas marinas se dirigen a los GPCR, transportadores de neurotransmisores y canales iónicos; varias de ellas (es decir, tetrodotoxina, saxitoxina, ácido kaínico y varios venenos de caracoles cónicos) han sido útiles para los investigadores. Una que se ha convertido en un tratamiento aprobado por la FDA para el dolor crónico es la ziconotida.
Ziconotida
La ziconotida es una copia sintética de una toxina neuroactiva del caracol cónico, un polipéptido básico de 25 aminoácidos con tres puentes disulfuro. La molécula es hidrofílica y fácilmente soluble en agua y solución salina isotónica.
Les comparto un video como resumen del tema:
